Micose fungóide em crianças e adolescentes: Relato de seis casos com predomínio da forma hipocromiante e revisão da literatura
Published Web Location
https://doi.org/10.5070/D37vt2r544Main Content
Micose fungóide em crianças e adolescentes: Relato de seis casos com predomínio da forma hipocromiante e revisão da literatura
Fernanda Arruda Rizzo MD1, Enoi Guedes Vilar MD2, Luciana Pantaleão MD2, Eliene Carvalho Fonseca MD3, Paula Ferrazzi Magrin MD4, Marcus Henrique-Xavier MD5, Mayra Carrijo Rochael MD6
Dermatology Online Journal 18 (3): 5
1. Patologista, Mestre em Patologia Humana da Universidade Federal Fluminense (UFF), Niterói/RJ, Brasil, Linha de pesquisa:
Etiopatogênese, epidemiologia e patologia celular / molecular de neoplasias humanas2. Dermatopatologistas do Hospital Universitário Antonio Pedro (HUAP) da UFF e Professoras do Departamento de Patologia da UFF, Brasil
3. Patologista responsável pelo Laboratório de Imuno-histoquímica e Hibridização do Departamento de Patologia do HUAP/UFF, Brasil
4. Médica residente de Dermatologia do HUAP/ UFF, Brasil
5. Dermatologista de Belo Horizonte/ MG, Brasil
6. Dermatopatologista do HUAP/UFF e Professora-Doutora do Departamento de Patologia da UFF, Brasil
Abstract
Mycosis fungoides (MF), the most common form of cutaneous T cell lymphoma (CTCL), is mainly manifested in the elderly. However, it has been described in children and teenagers. OBJECTIVES: To report six patients with mycosis fungoides diagnosed in patients under 20 years of age. Our focus is on epidemiologic data, clinical features, histopathological aspects, and immunophenotypical findings. METHODS: The files of all patients diagnosed with CTCL at Hospital Universitário Antônio Pedro (HUAP) / Universidade Federal Fluminense (UFF), Niterói, Brazil, from 2007 to 2010 were searched to identify patients under 20 years of age. Slides were reviewed with routine methods (H&E) and immunohistochemical stains by two dermatopathologists and one surgical pathologist. RESULTS: Among a total of 66 patients with MF, six were children and adolescents between five and nineteen years of age. Most of them had dark skin and presented with the hypopigmented variant of MF; some expressed the T cell CD8+ phenotype, although the prognosis remains the same as for classical CTCL. The main histopathological findings were basilar lymphocytes, Pautrier microabscesses, eccrine infiltration, and dermal fibrosis. One patient had shown pityriasis lichenoides chronica for 10 years before the diagnosis of MF. CONCLUSIONS: The incidence of juvenile mycosis fungoides has increased, corresponding to 9.1 percent of patients diagnosed with MF in our institution in four years. In this sample, 83.3 percent of the patients had the hypopigmented variant and 50 percent of them showed the CD3+/CD8+ T cells phenotype. We emphasize the occurrence of pityriasis lichenoides chronica before the onset of MF in one of our cases. This association, although rare, must be considered in cases of atypical evolution of PLC. The diagnosis of hypopigmented MF should also be considered in patients when hypochromic patches are persistent. We would like to highlight the importance of Pautrier microabscesses, basilar distribution, and eccrine involvement by neoplastic lymphocytes as histopathological diagnostic criteria for this variant of MF.
Introdução
Micose Fungóide (MF), linfoma de células T epidermotrópico CD4 positivo, representa o subtipo mais comum dos Linfomas Cutâneos Primários (LCP). Suas lesões passam por máculas que evoluem para placas e tumores, com curso indolente, sendo a maioria dos pacientes homens adultos, na faixa etária média dos 50 anos [1, 2, 33]. Entretanto, pode, ocasionalmente, afetar crianças e adolescentes [4-12]. Dentre todos os casos de MF, 0,5 a 5% representam pacientes menores de 20 anos de idade [4] com diagnóstico definitivo sendo feito entre dois a 10 anos após o início dos sintomas [5, 6]. No entanto, relatos de MF nesta faixa etária têm sido mais frequentes [7]. As células T neoplásicas da MF têm imunofenótipo CD3+ (Th2), CD4+ e CD8- [1, 2, 3], com raros casos CD4- CD8+, porém mantendo o comportamento clínico e prognóstico da MF clássica [1, 2, 8, 9].
No Hospital Universitário Antônio Pedro, Niterói, Brasil, no período de 2007 a 2010, 78 fragmentos de pele foram diagnosticados como MF, referentes a 66 pacientes, dos quais seis tinham menos de 20 anos de idade, cinco deles apresentando clínica da forma hipocrômica.
A MF hipocromiante tem como diagnósticos diferenciais pitiríase alba, vitiligo, pitiríase versicolor, pitiríase liquenóide crônica (PLC) e hanseníase indeterminada (MHI) [2, 5, 9, 11]. Afeta predominantemente pessoas de pele negra [8, 9, 10] e sua incidência é maior em crianças e adolescentes [4-6, 8-13].
Para melhor compreensão das características da MF na infância e adolescência, analisamos os achados clínicos, histopatológicos e imunofenotípicos de seis pacientes portadores de MF antes dos 20 anos de idade.
Métodos
Realizado levantamento das biópsias diagnosticadas como Micose Fungóide, no Serviço de Anatomia Patológica do Hospital Universitário Antônio Pedro/ Universidade Federal Fluminense (HUAP/ UFF), no período de 01 de janeiro de 2007 a 31 de dezembro de 2010, totalizando 78 biópsias, referentes a 66 pacientes. Dez dessas biópsias correspondiam a seis pacientes abaixo dos 20 anos de idade.
Dados demográficos e clínicos como sexo, idade, cor, apresentação clínica, hipóteses diagnósticas, tempo de evolução, sinais de doença sistêmica e tratamento foram analisados.
Para a revisão histopatológica das biópsias, foi elaborado protocolo modificado para o diagnóstico de MF, baseado nos critérios utilizados por Guitart J et al. (2001), Willemze R et al. (2005), Burg G et al. (2005) e Massone C. et. al. (2005) [2, 3, 14, 15].
Todas as biópsias foram revistas por três patologistas, sendo duas Dermatopatologistas e uma Patologista Geral.
A técnica de imuno-histoquímica foi realizada em fragmentos de tecido fixados em formalina 10%, embebidos em parafina, em cortes de 5µ de espessura, em lâminas de vidro previamente silanizadas (Sigma, código A3648), usando os seguintes anticorpos monoclonais anti-CD4 (diluição 1:50), CD5 (1:200), CD7 (1:100), CD8 (1:500) e CD20 (1:80) (DAKO) e policlonal CD3 (1:700). As lâminas foram desparafinadas em xilol e reidratadas em álcool. Bloqueio da peroxidase endógena foi realizado com solução de H2O2 a 3%, seguido de recuperação antigênica em banho-maria com citrato ph 6,0. A incubação com anticorpo primário foi feita “overnight” e com anticorpo secundário biotinilado com o complexo Mach 4, (Biocare Medical). Foi utilizado o cromógeno 3’-diaminobenzidine (DAB).
Resultados
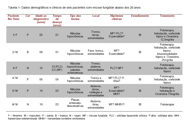 Tabela 1
Tabela 1
Embora a incidência da MF seja rara em crianças e adolescentes, o número desses relatos tem aumentado [7]. Descrevemos a ocorrência da MF em seis pacientes com menos de 20 anos, correspondendo a 9,1% dos pacientes com diagnóstico de MF no período analisado, com significante predomínio da forma clínica hipopigmentada (83,3%) e ocorrência do fenótipo CD8+ em 50% dos casos. Os dados clínicos e demográficos dos pacientes estão relacionados na Tabela 1.
No nosso estudo, houve prevalência de sexo masculino sobre o feminino (M/F:4/2), concordando a literatura [4, 6, 7]. A média de idade dos pacientes ao diagnóstico foi de 12 anos. A idade de aparecimento dos sintomas variou entre 02 e 16 anos de idade (média de 10 anos), semelhante à literatura [4, 6]. O tempo médio entre o aparecimento das lesões cutâneas e o diagnóstico histopatológico foi de 2,08 anos, similar à série de Kim ST (2009) [7], porém inferior aos casos de Ben-Amitai D (2003) e Wain EM (2003) [4, 6].
Micose Fungóide hipopigmentada é a forma do linfoma cutâneo de células T na qual a hipomelanose é a principal forma de manifestação clínica da doença [9]. Em 1973, o termo MF hipopigmentada foi descrito por Ryan EA et al., quando propuseram a hipótese da “origem epidérmica” da MF, sugerindo que focos de células linfóides neoplásicas poderiam proliferar-se e propagar-se dentro da epiderme, induzindo resposta inflamatória da derme e só depois a colonizando. Esses autores notaram o envolvimento precoce da camada basal da epiderme, responsabilizando tal fato pelas alterações pigmentares que podem ser vistas no decorrer da doença, tais como hipopigmentação isolada ou como componente da poiquilodermia, propondo a possível destruição dos melanócitos na pele afetada pelos linfócitos T neoplásicos e não neoplásicos ou por defeito na transferência da melanina para os ceratinócitos [13, 16]. Outros autores, através de estudos ultraestruturais, revelaram invasão focal da epiderme por células T neoplásicas com alterações degenerativas dos melanócitos e ceratinócitos adjacentes, reduzindo a produção de melanina, reforçando a teoria de Ryan EA et al. [11, 13, 17-19]. Em outra hipótese, Singh ZN et al. propuseram que a hipomelanose na MF hipocromiante esteja relacionada à baixa expressão do CD117 (“stem cell factor receptor/ KIT protein”) nos melanócitos, similar ao que ocorre no vitiligo, decorrente do efeito citotóxico dos LT CD8+ neoplásicos [20].
 |  |
| Figura 1 | Figura 2 |
|---|---|
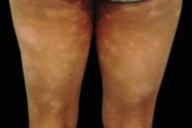
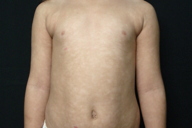
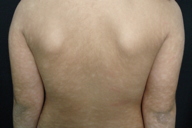
| Figuras 1 a 4. Paciente 1: Máculas hipocrômicas disseminadas | |
| Figures 1 to 4. Patient 1: Disseminated hypochromic patches | |
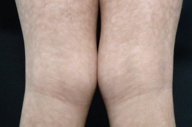
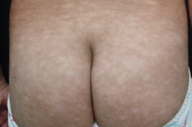 Figura 3
Figura 4
Figura 3
Figura 4
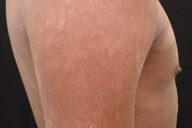 Figura 7
Figura 7
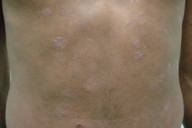
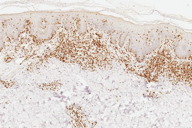
Micose Fungóide hipocromiante afeta predominantemente pessoas de pele negra [9, 11], embora possa ocorrer em brancos [5]. A maioria dos nossos pacientes que manifestaram a forma hipopigmentar da MF tinha pele escura (um negro e três pardos). Destacamos que, em nosso país, a população é miscigenada, dando margens a questionamentos do genótipo dos indivíduos de pele branca. Quanto à faixa etária, a incidência é maior em crianças e adolescentes [4, 5, 6, 8-13], ocorrendo em até 20,4% dos pacientes com MF nesta faixa etária [4]. Lesões hipopigmentadas geralmente ocorrem em combinação com as lesões clássicas [4, 5], porém, em nossa casuística, três dos cinco pacientes exibiam apenas máculas hipocrômicas (Figs. 1 a 5). Apenas o paciente 6 não manifestava tais lesões, ao contrário, apresentava placas eritemato-descamativas clássicas da MF (Figs. 6 e 7).
O diagnóstico diferencial clínico nessa amostra incluiu outras lesões maculares hipopigmentadas, tendo sido sugerido MF para todos os pacientes, ao contrário de algumas observações descritas na literatura [4, 5, 6] que não incluíram a MF na hipótese clínica inicial, além de PLC, eczemátide/ pitiríase alba e hanseníase.
No nosso estudo, as lesões tiveram predileção por tronco e membros, semelhante à descrição de outros autores, sendo esta a localização usual das lesões da MF em crianças e adolescentes [5]. Nenhum dos pacientes demonstrou sinais de doença sistêmica e foram considerados estadiamento IB ao momento do diagnóstico [14].
Foram realizadas múltiplas biópsias, conforme padronizado pela literatura [15]. Alguns autores têm sugerido a realização de biópsia única em “shave” para o diagnóstico de MF [21, 22].
 Tabela 2
Tabela 2
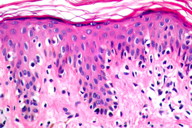
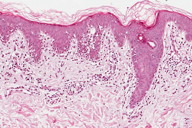
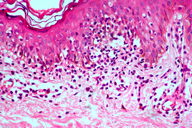
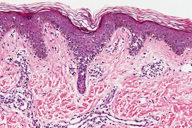
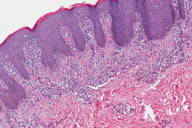
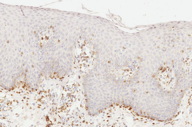
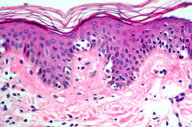
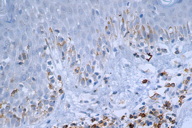
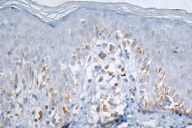
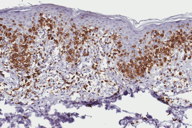
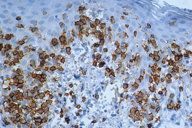
A histopatologia apresentou, predominantemente, acantose psoriasiforme, confirmando ausência de adelgaçamento da epiderme [11]. De maneira semelhante à literatura, que destaca a localização dos linfócitos neoplásicos na camada basilar como característica histopatológica frequente na MF hipocromiante, as biópsias de cinco dos nossos pacientes mostraram este aspecto, reforçando a sua importância como critério microscópico desta forma de MF [11] e, provavelmente, representando lesões mais precoces (Fig. 8). O epidermotropismo exuberante, principalmente de localização basilar, reforçaria as teorias a respeito da hipopigmentação [11, 17]. Microabscessos de Pautrier foram encontrados em 50% das biópsias, superando o encontrado na literatura que descreve alterações histopatológicas de lesões precoces [15, 23] (Fig. 9). Exocitose desproporcional ao grau de espongiose, halo perilinfocitário, distribuição pagetóide e atipia leve dos linfócitos contribuíram para o diagnóstico (Fig. 10). Na derme, predominou o infiltrado linfocitário de padrão perivascular, compatível com as fases inicias das lesões, acompanhado de fibroplasia da derme papilar e presença de eventuais linfócitos atípicos. Comprometimento écrino foi visto em quatro casos, enquanto o folicular em dois. Infiltração écrina, embora rara, reforça o diagnóstico de MF quando doenças inflamatórias são consideradas no diagnóstico diferencial clínico [24, 25] (Figs. 11 e 12). Foliculotropismo e siringotropismo linfocítico foi mais importante que o epidermotropismo em 36% dos casos analisados por Rongioletti F e Smoller B [24]. Como relatado por outros autores, as lesões mais precoces, maculares, mostraram infiltrado linfocitário na derme perivascular superficial, ao contrário da lesão em placa que exibia infiltrado de padrão liquenóide [1] (Figs. 13 a 15). Os critérios histopatológicos analisados e suas respectivas frequências estão relatados na Tabela 2.
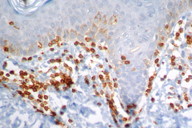
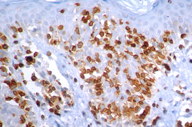
O estudo imuno-histoquímico dos seis casos demonstrou positividade com o anticorpo anti-CD3 na maioria dos linfócitos, com perda da expressão de CD5 e CD7, principalmente na epiderme, confirmando, junto com a correlação clínico-patológica, o diagnóstico de micose fungóide [1-3, 20, 23-27] (Figs. 16 a 19). Vale ressaltar a ocorrência do imunofenótipo de células T CD8+ em 50% dos casos. Embora a expressão dos linfócitos T helper CD4 seja a regra, o predomínio de linfócitos T citotóxicos na epiderme tem sido descrito na literatura, porém sem interferência no prognóstico da doença [5, 6]. Alguns autores referem, inclusive, que a variante da MF CD8+ é mais frequente em crianças e adolescentes, nas lesões hipopigmentadas e com maior prevalência no sexo feminino [5, 8, 9, 28] (Figs. 20 e 21).
Um dos pacientes, cujo diagnóstico de MF hipocrômica deu-se aos 15 anos, tinha PLC diagnosticado aos cinco anos. A evolução da pitiríase liquenóide crônica para MF CD8+ já foi descrita em crianças e adolescentes. Tomasini D et al. acreditam que o microambiente imunológico induzido pela PLC na pele favorece o desenvolvimento do clone tumoral e Boccara O et al. (2011) enfatizam que a PLC pode predispor ao aparecimento da MF especialmente em crianças e que, portanto, o seguimento clínico destes pacientes é fundamental [12, 28].
A detecção da clonalidade de células T, através das técnicas de reação em cadeia de polimerase (PCR), pode não ser evidente nas lesões precoces da MF, como ocorre nas lesões em estágios mais avançados, permanecendo a microscopia ótica, juntamente a correlação clínica e seguimento, como padrão ouro para o diagnóstico de lesões precoces da MF [16, 29, 30].
O tratamento da MF difere de acordo com o estágio da doença. Na MF precoce, inclui psoraleno em associação com irradiação UVA (PUVA), interferon α-2ª e retinóides [31-34]. Micose Fungóide hipopigmentada em adultos e crianças parece responder a corticosteróides tópicos, UVB, PUVA, mostarda nitrogenada tópica ou carmustine tópico [5]. Nos estágios mais avançados, em adição ao PUVA, retinóides e interferon-α, quimioterapia sistêmica convencional, fotoferese extracorpórea e radioterapia tem sido utilizadas, assim como agentes imunológicos [35-38]. No entanto, o tratamento da MF na fase tumoral ainda permanece insatisfatório. Tem sido descrita a progressão da MF não diagnosticada para a fase tumoral ao utilizar-se tratamento com agentes imunológicos, especialmente nos casos de associação com outras dermatoses ou em casos diagnosticados erroneamente como dermatite atópica ou psoríase [39, 40, 41].
O tratamento de escolha nos nossos casos foi associação de fototerapia, hidratação e corticoterapia, com boa resposta terapêutica. Dois pacientes não seguiram com tratamento na instituição.
Conclusão
A incidência de micose fungóide em crianças e adolescentes tem aumentado, representando 9,1% dos pacientes com diagnóstico de MF na nossa instituição em quatro anos. Nesta amostra, a MF cursou com lesões hipocromiantes em 83,3% dos pacientes, com imunofenótipo CD3+/CD8+ em 50% deles. Ressaltamos a ocorrência de pitiríase liquenóide crônica precedendo o aparecimento de MF em um dos nossos casos. Esta associação, embora rara, deve ser lembrada nos casos de evolução atípica da PLC. O diagnóstico de MF hipocromiante deve também ser considerado em pacientes com máculas hipocrômicas não responsivas a tratamentos clínicos, principalmente em nosso meio, onde há grande miscigenação racial, devido à grande incidência desta variante neoplásica em indivíduos com pele fototipo alto. Apesar das lesões serem precoces, histopatologicamente destacamos a grande freqüência de microabscessos de Pautrier e a importância da distribuição basilar e o comprometimento écrino pelos linfócitos neoplásicos como critérios diagnósticos desta variante de MF.
References
1. Jaffe, E.S. et al. World Health Organization Classification of Tumors: Pathology and Genetics of Tumors of Hematopoietic and Lymphoid Tissues. Lyon: IARC Press, 2001.2. Willemze R, Jaffe ES, Burg G, Cerroni L, Berti E, Swerdlow SH, Ralfkiaer E, Chimenti S, Diaz-Perez JL, Duncan LM, Grange F, Harris NL, Kempf W, Kerl H, Kurrer M, Knobler R, Pimpinelli N, Sander C, Santucci M, Sterry W, Vermeer MH, Wechsler J, Whittaker S, Meijer CJ. WHO-EORTC classification for cutaneous lymphomas. Blood. 2005 May 15;105(10):3768-85. Epub 2005 Feb 3. Review. [PubMed]
3. Burg G, Kempf W, Cozzio A, Feit J, Willemze R, S Jaffe E, Dummer R, Berti E, Cerroni L, Chimenti S, Diaz-Perez JL, Grange F, Harris NL, Kazakov DV, Kerl H, Kurrer M, Knobler R, Meijer CJ, Pimpinelli N, Ralfkiaer E, Russell-Jones R, Sander C, Santucci M, Sterry W, Swerdlow SH, Vermeer MH, Wechsler J, Whittaker S. WHO/EORTC classification of cutaneous lymphomas 2005: histological and molecular aspects. J Cutan Pathol. 2005 Nov;32(10):647-74. Review. [PubMed]
4. Ben-Amitai D, Michael D, Feinmesser M, Hodak E. Juvenile mycosis fungoides diagnosed before 18 years of age. Acta Derm Venereol. 2003;83(6):451-6. [PubMed]
5. Neuhaus IM, Ramos-Caro FA, Hassanein AM. Hypopigmented mycosis fungoides in childhood and adolescence. Pediatr Dermatol. 2000 Sep-Oct;17(5):403-6. Review. [PubMed]
6. Wain EM , Orchard GE, Whittaker SJ, Spittle M Sc MF, Russell-Jones R. Outcome in 34 patients with juvenile-onset mycosis fungoides: a clinical, immunophenotypic, and molecular study. Cancer. 2003 Nov 15;98(10):2282-90. [PubMed]
7. Kim ST, Sim HJ, Jeon YS, Lee JW, Roh HJ, Choi SY, Kim YJ, Suh KS. Clinicopathological features and T-cell receptor gene rearrangement findings of mycosis fungoides in patients younger than age 20 years. J Dermatol. 2009 Jul;36(7):392-402. [PubMed]
8. Whittam LR, Calonje E, Orchard G, Fraser-Andrews EA, Woolford A, Russell-Jones R. CD8-positive juvenile onset mycosis fungoides: an immunohistochemical and genotypic analysis of six cases. Br J Dermatol. 2000 Dec;143(6):1199-204. [PubMed]
9. El-Shabrawi-Caelen L, Cerroni L, Medeiros LJ, McCalmont TH. Hypopigmented mycosis fungoides: frequent expression of a CD8+ T-cell phenotype. Am J Surg Pathol. 2002 Apr;26(4):450-7. [PubMed]
10. Werner B, Brown S, Ackerman AB. "Hypopigmented mycosis fungoides" is not always mycosis fungoides! Am J Dermatopathol. 2005 Feb;27(1):56-67. Review. [PubMed]
11. Lambroza E, Cohen SR, Phelps R, Lebwohl M, Braverman IM, DiCostanzo D. Hypopigmented variant of mycosis fungoides: demography, histopathology, and treatment of seven cases. J Am Acad Dermatol. 1995 Jun;32(6):987-93. [PubMed]
12. Boccara O, Blanche S, de Prost Y, Brousse N, Bodemer C, Fraitag S. Cutaneous hematologic disorders in children. Pediatr Blood Cancer. 2011 Mar 28. doi: 10.1002/pbc.23103. [PubMed]
13. Khopkar U, Doshi BR, Dongre AM, Gujral S. A study of clinicopathologic profile of 15 cases of hypopigmented mycosis fungoides. Indian J Dermatol Venereol Leprol. 2011 Mar-Apr;77(2):167-73. [PubMed]
14. Olsen E, Vonderheid E, Pimpinelli N, Willemze R, Kim Y, Knobler R, Zackheim H, Duvic M, Estrach T, Lamberg S, Wood G, Dummer R, Ranki A, Burg G, Heald P, Pittelkow M, Bernengo MG, Sterry W, Laroche L, Trautinger F, Whittaker S; ISCL/EORTC. Revisions to the staging and classification of mycosis fungoides and Sezary syndrome: a proposal of the International Society for Cutaneous Lymphomas (ISCL) and the cutaneous lymphoma task force of the European Organization of Research and Treatment of Cancer (EORTC). Blood. 2007 Sep 15;110(6):1713-22. Epub 2007 May 31. Review. Erratum in: Blood. 2008 May 1;111(9):4830. [PubMed]
15. Massone C, Kodama K, Kerl H, Cerroni L. Histopathologic features of early (patch) lesions of mycosis fungoides: a morphologic study on 745 biopsy specimens from 427 patients. Am J Surg Pathol. 2005 Apr;29(4):550-60. [PubMed]
16. Guitart J, Kennedy J, Ronan S, Chmiel JS, Hsiegh YC, Variakojis D. Histologic criteria for the diagnosis of mycosis fungoides: proposal for a grading system to standardize pathology reporting. J Cutan Pathol. 2001 Apr;28(4):174-83. [PubMed]
17. Ryan EA, Sanderson KV, Bartak P, Samman PD. Can mycosis fungoides begin in the epidermis? A hypothesis. Br J Dermatol 1973;88:419-29. [PubMed]
18. Breathnach SM, McKee PH, Smith NP. Hypopigmented mycosis fungoides: report of five cases with ultrastructural observations. Br J Dermatol 1982; 106: 643-49. [PubMed]
19. Goldberg DJ, Schinella RS, Kechijian P. Hypopigmented mycosis fungoides. Speculations about the mechanism of hypopigmentation. Am J Dermatopathol. 1986 Aug;8(4):326-30. [PubMed]
20. Singh ZN, Tretiakova MS, Shea CR, Petronic-Rosic VM. Decreased CD117 expression in hypopigmented mycosis fungoides correlates with hypomelanosis: lessons learned from vitiligo. Mod Pathol. 2006 Sep;19(9):1255-60. Epub 2006 Jun [PubMed]
21. Fung MA, Murphy MJ, Hoss DM, Grant-Kels JM. Practical evaluation and management of cutaneous lymphoma. J Am Acad Dermatol. 2002 Mar; 46(3):325-57; quiz, 358-60. Review. [PubMed]
22. Brooks C, Pulitzer MP, Brownell I. Longitudinal lift biopsy technique with flat fixation for the diagnosis of mycosis fungoides. Int J Dermatol. 2011 Jul; 50(7):875-6. doi: 10.1111/j.1365-4632.2010.04806.x. [PubMed]
23. Pimpinelli N, Olsen EA, Santucci M, Vonderheid E, Haeffner AC, Stevens S, Burg G, Cerroni L, Dreno B, Glusac E, Guitart J, Heald PW, Kempf W, Knobler R, Lessin S, Sander C, Smoller BS, Telang G, Whittaker S, Iwatsuki K, Obitz E, Takigawa M, Turner ML, Wood GS; International Society for Cutaneous Lymphoma. Defining early mycosis fungoides. J Am Acad Dermatol. 2005 Dec;53(6):1053-63. Review. [PubMed]
24. Rongioletti F, Smoller B. The histologic value of adnexal (eccrine gland and follicle) infiltration in mycosis fungoides. J Cutan Pathol. 2000 Sep; 27(8):406-9. [PubMed]
25. Inchara YK, Rajalakshmi T. Early mycosis fungoides vs. inflammatory mimics: how reliable is histology? Indian J Dermatol Venereol Leprol. 2008 Sep-Oct;74(5):462-6. [PubMed]
26. Vilar, Enoi Guedes. Estudo analítico do perfil imuno-histoquímico linfocitário da fase precoce da micose fungóide. 2006. Dissertação (Mestrado em Patologia, Área de Concentração: Anatomia Patológica) – Faculdade de Medicina – Universidade Federal Fluminense, Niterói
27. Cotta AC, Cintra ML, de Souza EM, Chagas CA, Magna LA, Fleury RN, Brousset P, Vassallo J. Diagnosis of mycosis fungoides: a comparative immunohistochemical study of T-cell markers using a novel anti-CD7 antibody. Appl Immunohistochem Mol Morphol. 2006 Sep;14(3):291-5. [PubMed]
28. Tomasini D, Zampatti C, Palmedo G, Bonfacini V, Sangalli G, Kutzner H. Cytotoxic mycosis fungoides evolving from pityriasis lichenoides chronica in a seventeen-year-old girl. Report of a case. Dermatology. 2002;205(2):176-9. [PubMed]
29. Naraghi ZS, Seirafi H, Valikhani M, Farnaghi F, Kavusi S, Dowlati Y. Assessment of histologic criteria in the diagnosis of mycosis fungoides. Int J Dermatol. 2003 Jan;42(1):45-52. [PubMed]
30. Kempf W, Sander CA. Classification of cutaneous lymphomas - an update. Histopathology. 2010 Jan;56(1):57-70. Review. [PubMed]
31. Chiarion-Sileni V, Bononi A, Fornasa CV, Soraru M, Alaibac M, Ferrazzi E, Redelotti R, Peserico A, Monfardini S, Salvagno L. Phase II trial of interferon-alpha-2a plus psolaren with ultraviolet light A in patients with cutaneous T-cell lymphoma. Cancer. 2002 Aug 1;95(3):569-75. [PubMed]
32. Stadler R, Otte HG, Luger T, Henz BM, Kühl P, Zwingers T, Sterry W. Prospective randomized multicenter clinical trial on the use of interferon-2a plus acitretin versus interferon-2a plus PUVA in patients with cutaneous T-cell lymphoma stages I and II. Blood. 1998 Nov 15;92(10):3578-81. [PubMed]
33. Rupoli S, Goteri G, Pulini S, Filosa A, Tassetti A, Offidani M, Filosa G, Mozzicafreddo G, Giacchetti A, Brandozzi G, Cataldi I, Barulli S, Ranaldi R, Scortechini AR, Capretti R, Fabris G, Leoni P; Marche Regional Multicentric Study Group of Cutaneous Lymphomas. Long-term experience with low-dose interferon-alpha and PUVA in the management of early mycosis fungoides. Eur J Haematol. 2005 Aug;75(2):136-45. [PubMed]
34. Trautinger F, Knobler R, Willemze R, Peris K, Stadler R, Laroche L, D'Incan M, Ranki A, Pimpinelli N, Ortiz-Romero P, Dummer R, Estrach T, Whittaker S. EORTC consensus recommendations for the treatment of mycosis fungoides/Sézary syndrome. Eur J Cancer. 2006 May;42(8):1014-30. Epub 2006 Mar 30. [PubMed]
35. Carretero-Margolis CD, Fivenson DP. A complete and durable response to denileukin diftitox in a patient with mycosis fungoides. J Am Acad Dermatol. 2003 Feb;48(2):275-6. [PubMed.
36. Lundin J, Hagberg H, Repp R, Cavallin-Ståhl E, Fredén S, Juliusson G, Rosenblad E, Tjønnfjord G, Wiklund T, Osterborg A. Phase 2 study of alemtuzumab (anti-CD52 monoclonal antibody) in patients with advanced mycosis fungoides/Sezary syndrome. Blood. 2003 Jun 1;101(11):4267-72. Epub 2003 Jan 23. [PubMed]
37. Yano H, Ishida T, Inagaki A, Ishii T, Ding J, Kusumoto S, Komatsu H, Iida S, Inagaki H, Ueda R. Defucosylated anti CC chemokine receptor 4 monoclonal antibody combined with immunomodulatory cytokines: a novel immunotherapy for aggressive/refractory Mycosis fungoides and Sezary syndrome. Clin Cancer Res. 2007 Nov 1;13(21):6494-500. [PubMed]
38. Quereux G, Marques S, Nguyen JM, Bedane C, D'incan M, Dereure O, Puzenat E, Claudy A, Martin L, Joly P, Delaunay M, Beylot-Barry M, Vabres P, Celerier P, Sasolas B, Grange F, Khammari A, Dreno B. Prospective multicenter study of pegylated liposomal doxorubicin treatment in patients with advanced or refractory mycosis fungoides or Sézary syndrome. Arch Dermatol. 2008 Jun;144(6):727-33. [PubMed]
39. Hernandez C, Worobec SM, Gaitonde SS, Kiripolsky ML, Aquino K. Progression of undiagnosed cutaneous T-cell lymphoma during efalizumab therapy. Arch Dermatol. 2009 Jan;145(1):92-4. [PubMed]
40. Lafaille P, Bouffard D, Provost N. Exacerbation of undiagnosed mycosis fungoides during treatment with etanercept. Arch Dermatol. 2009 Jan;145(1):94-5. [PubMed]
41. Chuang GS, Wasserman DI, Byers HR, Demierre MF. Hypopigmented T-cell dyscrasia evolving to hypopigmented mycosis fungoides during etanercept therapy. J Am Acad Dermatol. 2008 Nov;59(5 Suppl):S121-2. [PubMed]
© 2012 Dermatology Online Journal