Endometriose cutânea - a propósito de um caso clínico
Published Web Location
https://doi.org/10.5070/D31h67x0cgMain Content
Endometriose cutânea - a propósito de um caso clínico
Tiago Esteves, Jorge Cabrita, Ricardo Coelho, Esmeralda Vale
Dermatology Online Journal 16 (5): 9
Hospital Central do FunchalAbstract
Case report: A 26-year-old woman presented with a history of a dark red, asymptomatic, firm, dome-shaped tumor, approximately 2.5 cm in diameter. The nodule had been developing for one year near a scar in the lower abdominal wall. Her past medical history was significant for a caesarean section five years prior to presentation. Histopathological examination revealed numerous glands of various sizes exhibiting small to large lumina, surrounded by a cellular, edematous stroma composed of spindle-shaped cells or round large cells admixed with lymphocytes, plasma cells, and few eosinophils. Comment: Cutaneous endometriosis is a well recognized but uncommon entity, representing approximately 1 percent of all cases of ectopic endometrial tissue. It may arise spontaneously within the umbilicus or inguinal region, but the majority of lesions develop on surgical excisions of the abdominal and genital regions (cesarean sections, hysterectomy, laparotomy, laparoscopy, and episiotomy) in women of reproductive age. The pathogenesis of cutaneous endometriosis is still not clear and several theories have been put forward to explain its development. Despite its clinical rarity, cutaneous endometriosis is a well-known condition to dermatopathologists. Nevertheless, they should be aware of those unusual metaplastic changes that may represent a diagnostic pitfall.
Introdução
O termo endometriose define o crescimento anormal de tecido endometrial, fora da cavidade uterina. Originariamente, foram descritas duas variantes, a endometriose interna e externa. A interna, definida como adenomiose, é caracterizada pelo crescimento de tecido endometrial benigno no miométrio. A externa divide-se em: a) endometriose pélvica, em que se verifica a presença de tecido endometrial em todos os locais anatomicamente próximos do útero (exemplo: trompas e ovários); e b) endometriose extrapélvica, podendo afectar qualquer órgão ou tecido do corpo humano, nomeadamente o sistema nervoso central, tórax, sistema urinário, gastrointestinal, extremidades e tecido celular subcutâneo.
Caso Clínico
 |
| Figure 1 |
|---|
| Figure 1. Cutaneous endometriosis located in cesarean section scar |
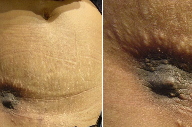
Descreve-se o caso de uma doente do sexo feminino, de 26 anos de idade, observada na consulta de Dermatologia do Hospital Distrital de Faro por nódulo acastanhado, arredondado, bem delimitado, firme, de superfície lisa, com 2,5 cm de diâmetro, assintomático, com 1 ano de evolução, localizado no quadrante inferior do abdómen sobre uma das extremidades da cicatriz de cesariana (Fig. 1).
Dos antecedentes pessoais salienta-se parto distócico, por cesariana, na sequência de pré-eclâmpsia, 5 anos antes do início do quadro clínico. Sem outros antecedentes pessoais ou familiares de relevo.
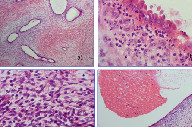
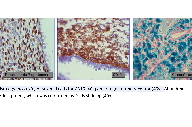
Foi efectuada biopsia cutânea que apenas revelou parte de glândula apócrina, pelo que foi sugerido excisão total da lesão, cujo exame histopatológico revelou a presença, na derme papilar e reticular, de numerosas glândulas envolvidas num estroma fibroso, focalmente mucinoso constituído por células fusiformes, células arredondadas e denso infiltrado inflamatório. As glândulas são revestidas por epitélio colunar, pseudoestratificado, verificando-se secreção por decapitação. No seu lúmen observam-se eritrócitos, neutrófilos e material eosinofílico amorfo (Fig. 2). A marcação imunohistoquímica evidenciou positividade das células do estroma para o CD10 e receptores de progesterona. Focalmente disperso pelo estroma, observa-se pigmento hemosiderínico abundante, que se confirmou pela coloração de Perls (Fig. 3). Os aspectos clínicos, histológicos e imunohistoquímicos foram compatíveis com o diagnóstico de Endometriose cutânea.
A avaliação analítica não revelou alterações.
Comentário
A endometriose cutânea (EC) é uma entidade bem reconhecida, porém rara, representando, aproximadamente, 1% de todos os casos de tecido endometrial ectópico [1]. Embora possa afectar qualquer órgão ou tecido do corpo humano, a endometriose extra-pélvica é muito menos frequente do que a pélvica, sendo responsável por cerca de 12% dos casos [2].
Pode ocorrer de modo espontâneo, na região umbilical ou inguinal mas, na grande maioria dos casos, as lesões desenvolvem-se em cicatrizes cirúrgicas da região abdominal e genital, de mulheres em idade reprodutiva, nomeadamente: cicatrizes de cesariana (0.03% a 0.4%) [3] (Quadro 1), histerectomia, laparotomia, laparoscopia e episiotomia [4]. Raramente, pode, também, ser encontrada em mulheres pós menopáusicas [5].
A etiopatogenia da EC não está, ainda, bem esclarecida. Existem duas teorias que procuram explicar o seu desenvolvimento: a) o desenvolvimento in situ por metaplasia embrionária; e b) o desenvolvimento por implantação de células endometriais viáveis, quer seja por regurgitação, disseminação linfática ou hematogénea, ou de modo mecânico, durante a manipulação cirúrgica.
No início do século XX, Robert Mayer (1919) apresentou a teoria da metaplasia embrionária, afirmando que as células peritoniais são embriologicamente derivadas do epitélio celômico e, consequentemente, retêm a capacidade de produzir tecido endometrial quando devidamente estimuladas. Esses estímulos podem ser hormonais, inflamatórios ou de outra natureza não conhecida [6]. No entanto, a explicação mais popular para a compreensão da patogénese da endometriose é a teoria da implantação de células endometriais viáveis. Com base na sua experiência clínica, Sampson (1927) propôs que o sangue menstrual, através de um mecanismo de regurgitação retrógrada menstrual das trompas para a cavidade peritoneal, seria responsável pelo transporte e implantação de células endometriais viáveis em sítios ectópicos. Para além da disseminação directa transtubária, pode também ocorrer disseminação do tecido endometrial através dos vasos sanguíneos ou linfáticos [6].
A etiopatogénese da endometriose que se desenvolve em cicatrizes é melhor explicada pela combinação das duas teorias [7, 8, 9, 10, 11]. Durante a realização de um procedimento cirúrgico, o tecido endometrial é directamente inoculado na ferida cirúrgica, permanecendo essas células endometriais viáveis, proliferando sob estímulo hormonal adequado ou induzindo o tecido à sua volta a sofrer metaplasia e desenvolver a endometriose no local da cicatriz.
Clinicamente, a EC manifesta-se como um tumor de cor castanho-azulado, frequentemente doloroso e mostrando, por vezes, variação cíclica no tamanho e sintomas. A dor cíclica durante cada menstruação é quase patognomónica de endometriose em cicatrizes cirúrgicas. Pode, ainda, ser assintomático (tipo silencioso), ou, apresentar comportamento hemorrágico durante a menstruação [12, 13, 14].
O intervalo de tempo entre o procedimento cirúrgico e o início dos sintomas é variável, de alguns meses a vários anos, com uma média de 3 anos [15].
O diagnóstico diferencial clínico desta patologia é extenso, principalmente com outras patologias benignas, tais como o granuloma da cicatriz, quelóide, hérnia ou lipoma, no entanto, salientamos o interesse e a importância do reconhecimento e diagnóstico diferencial com outras entidades dermatológicas, nomeadamente o Melanoma maligno, tumor vascular ou metástases cutâneas.
O exame histopatológico de toda a lesão é importante para a confirmação em definitivo do diagnóstico de EC. O diagnóstico histológico é baseado na identificação de glândulas endometriais características, envolvidas num estroma fibroso. Também é importante salientar que, para um diagnóstico preciso de EC, deve-se ter em atenção as diferentes características histopatológicas das principais fases do ciclo menstrual, visto estas estarem relacionadas com os diferentes aspectos observados na EC.
As glândulas são normalmente revestidas por células colunares, com núcleos grandes e ovais, nucléolos proeminentes e numerosos grânulos de glicogénio (PAS+) no citoplasma. As mitoses são frequentes na fase proliferativa.
Fenómenos de "secreção por decapitação" são frequentemente observados na superfície luminal das células epiteliais (fase secretora). No lúmen das glândulas observam-se eritrócitos, neutrófilos e material eosinofílico amorfo, que evidencia positividade para PAS e Azul de Alcian.
O estroma que envolve as glândulas é constituído por células fusiformes com actividade mitótica moderada (fase proliferativa), células arredondadas e denso infiltrado inflamatório.
A imunomarcação com o anticorpo CD10 melhora a sensibilidade diagnóstica, na medida em que este marcador está sempre presente no estroma endometrial, corando o citoplasma das células. Os receptores de progesterona e estrogénio marcam positivamente os núcleos, quer das células epiteliais ou do estroma.
A decidualização é uma manifestação muito rara, mas pode também estar presente, e pode ser confundido com malignidade [16]. O desenvolvimento de doença maligna em endometriose de cicatriz é extremamente raro [17].
A terapêutica de 1ª linha é a excisão completa da lesão, com boa margem de segurança (no mínimo 1 cm de margem livre) para evitar a recorrência e afastar a possibilidade de doença maligna, no entanto, está descrito na literatura a utilização da terapêutica hormonal [18] de forma semelhante à utilizada para a endometriose pélvica, especialmente indicada em determinadas situações: a) em caso de lesões tumorais de grandes dimensões, a terapêutica hormonal pode ser usada no pré-operatório, para reduzir o tamanho das lesões, facilitar a sua exérese e diminuir a ocorrência de hérnias incisionais; b) coexistência de endometriose pélvica; e c) recusa na cirurgia.
O tratamento hormonal baseia-se no uso de androgénios (danazol, gestrinona), progestagénios, anovulatórios e agonistas da hormona libertadora de gonadotrofina (GnRH).
References
1. Latcher JW: Endometriosis of umbilicus. Am J Obstetric Gynecol 1953; 66:161-168 [PubMed]2. Rock JA, Markham SM. Extrapelvic endometriosis. In: Wilson EA, editor. Endometriosis. New York: Alan R Liss 1987: 185-206
3. Liang CC, Liou B, Tsai CC, et al. Scar endometriosis. International Surgery 1998; 83:69-71 [PubMed]
4. Yackovich FH, Bender GN, Tsuchida AM. Case report: peri-anal episiotomy scar endometrioma imaged by CT and sector endoluminal ultrasound. Clin Radiol 1994; 49:578-579 [PubMed]
5. Choi SW, Lee HN, Kang SJ, et al. A case of cutaneous endometriosis developed in postmenopausal woman receiving hormonal replacement. J Am Acad Dermatol 1999; 41:327-329 [PubMed]
6. Kistner RW. Tratado de Ginecologia Segunda Edição 1983, Ediciones Toray, S.A., Barcelona, p. 830
7. Nora E, Meyer KA, Carbonera P. Ectopic endometrium in abdominal scars following cesarean section. Am J Obstetric Gynecol 1956; 71(4):876-884 [PubMed]
8. Popoff L, Raitcheev R, Andreev VCH. Endometriosis of the skin. Arch Dermatol 1962; 85(2):66-69 [PubMed]
9. Ridley JH, Edwards IK. Experimental endometriosis in the human. Am J Obstetric Gynecol 1958; 76(4):785-790 [PubMed]
10. Scott RB, Te Linde RW. Probable viability of menstrually shed fragments of endometrium. Obstetric Gynecol 1954; 4(11):502-510 [PubMed]
11. Steck WD, Helwig EB. Cutaneous endometriosis. Clin Obstetric Gynecolog 1966; 9(1):373-380 [PubMed]
12. Blanco RG, et al. Abdominal wall endometriomas. Am J Surg 2003; 185:596-598 [PubMed]
13. Wolf GC, Singh KB. Cesarean scar endometriosis: a review. Obstetric Gynecol Surv 1989; 44(2):89-95 [PubMed]
14. Koger KE, et al. Surgical scar endometrioma. Surg Gynecol Obstet 1993; 177(9):243-247 [PubMed]
15. Seydel AS, et al. Extrapelvic endometriosis: diagnosis and treatment. Am J Surg 1996; 171(2):239-241 [PubMed]
16. Pellegrini AE, et al. Cutaneous decidualized endometriosis Ð a pseudomalignancy. Am J Dermatopathology 1982; 4(2):171-174 [PubMed]
17. Chene G, Darcha C, Dechelotte P, et al. Malignant degeneration of perineal endometriosis in episiotomy scar, case report and review of the literature. Int J Gynecol Cancer 2007; 17:705-734 [PubMed]
18. Purvis RS, Tyring SK. Cutaneous and subcutaneous endometriosis – surgical and hormonal therapy. J Dermatol Surg Oncol 1994; 20:693-695 [PubMed]
© 2010 Dermatology Online Journal